KNORPELDEFEKTE
Aufbau des hyalinen Knorpels
Die Gelenkflächen sind mit einem hyalinem Knorpel überzogen. Hyalin bedeutet durchscheinend, glasig. Neben hyalinem Knorpel gibt es im Körper noch elastischen Knorpel (z.B. Ohrmuschel) und Faserknorpel (alle Ringe oder Scheiben in den Gelenken – z.B. die Menisken). Der intakte hyaline Knorpel bewirkt, dass die gegenüberliegenden Gelenkflächen aneinander angepasst werden und ermöglicht eine reibungsarme Beweglichkeit. (Video Guter Knorpel)
Er reduziert Druck- und Scherbelastungen. Der Wasseranteil des hyalinen Knorpels kann bis zu 80% betragen. Die Trockensubstanz im Raum zwischen den Knorpelzellen besteht im Wesentlichen aus Kollagen Typ II und hochmolekularen Proteoglykanen. Bei Steigerung des externen Druckes durch Gelenkbelastung, verhält sich der gesunde hyaline Knorpel wie ein Schwamm, er reagiert mit elastischer Verformung seines molekularen Gerüstwerks und der Ausschleusung von Wasser in den Gelenkspalt, das bei Entlastung dann wieder in das Gewebe zurückströmt und gebunden wird. Die Höhe des maximal kompensierbaren Belastungsdrucks wird durch das Wechselspiel von gebundenem und freiem Wasser bestimmt und damit letztlich durch die Integrität und Funktionsfähigkeit der extrazellulären Matrix des Knorpels (1). Gewebearchitektur, Kollagen-Typ-II- und Proteoglykangehalt und damit auch die Fähigkeit zur Wasserbindung und Verteilung – die beide in direkter Beziehung zu den biomechanischen Eigenschaften des Gewebes stehen – unterscheiden sich bei Faserknorpel wesentlich von denen des hyalinen Gelenkknorpels. Dies erklärt auch, warum Faserknorpel, wie er z.B. überwiegend nach Mikrofrakturierung entsteht, nicht die gleiche biomechanische Belastbarkeit aufweist wie hyaliner Knorpel.
Der hyaline Gelenkknorpel ist nicht mit Nerven versorgt und hat auch keine Blutversorgung. Die Sauerstoff- und Nährstoffversorgung der Knorpelzellen erfolgt über relativ lange Diffusionsstrecken, unterstützt durch den Pumpmechanismus beim Wechsel von Be- und Entlastung. Die Knorpelzellen (ca. 1% des Knorpelvolumens) haben nur eine eingeschränkte Teilungsfähigkeit. Dadurch ist beim Erwachsenen nur eine eingeschränkte Knorpelregeneration möglich.
Was passiert nach einem Knorpelschaden?
Nach einem Knorpel- oder auch Meniskusschaden z.B. als Folge einer Verletzung, vergrößert sich die Last pro Fläche im Gelenk, was zu einer höheren Druckbelastung des noch verbliebenen, intakten Knorpelgewebes führt (2). Dieses Problem nimmt mit der Größe eines Knorpelschadens zu, wobei die größten Belastungen durch Scherkräfte an den Rändern des Defekts auftreten und es als Folge dessen zum Absterben der Knorpelzellen kommen kann (3, 4). Der Knorpelzelltod nimmt mit höherer Belastung zu [5]. Das bedeutet, dass Knorpelschäden nach Schluss der Wachstumsfugen die Entstehung einer Kniegelenksarthrose begünstigen. Das Risiko nimmt proportional zur Größe des ursprünglichen Knorpeldefektes zu (2). Nicht alle Knorpelschäden führen zunächst zu Schmerzen, da der Knorpel nicht durchblutet ist. Obwohl inzwischen auch nachgewiesen werden konnte, dass selbst asymptomatische Knorpeldefekte zur Progression neigen, besteht z. Zt noch weitgehend Einigkeit, dass in der Regel nur der klinisch symptomatische und vollschichtige Knorpelschaden eine Indikation zur chirurgischen Knorpeltherapie darstellt. (6). Zufällig mittels MRT, z.B. im Rahmen von Unfallereignissen gefundene asymptomatische Schäden, sollten bis zur Vorlage weiterer Erkenntnisse nicht biologisch rekonstruiert werden. Die ideale Indikation für eine biologische Knorpelrekonstruktion ist der unfallbedingte isolierte, von gesundem Umgebungsgewebe begrenzte 3-4- gradige Knorpeldefekt.

Die häufigste Klassifikation von Knorpelschäden ist die der International Cartilage Repair Society (ICRS) (20):
Abb 1 ICRS Einteilung
Die ideale Ausgangssituation für eine biologische Knorpelrekonstruktion ist der isolierte, von gesundem Umgebungsgewebe begrenzte, vollschichtige Schaden mit intakter Gelenkfläche. Es erscheint auf Basis der verfügbaren Literatur auch gerechtfertigt, die Indikation zur knorpelchirurgischen Operation auf den begrenzt degenerativen Defekt auszudehnen, sofern dieser klinisch auffällig ist, und die Umgebung intakt ist. [6]
Biologische Knorpelrekonstruktion
Die operativen Therapiemöglichkeiten lassen sich in knochenstimulierende Techniken und Transplantationen unterteilen. Alle diese Operationen sind nur sinnvoll bei hochgradigem Knorpelschaden (3.-4.Grad).
Knochenstimulierende Operationen sind Mikrofrakturierung, Abrasionsarthroplastik und Anbohrungen. Zu den Transplantationen zählen die osteochondralen Transplantationen (Mosaikplastik, OATS, OCT) und die autologe Knorpeltransplantation (ACT). (Video Mikrofrakturierung)
Knochenstimulierende Operationen
Bei den knochenstimulierenden Verfahren wird mit einem arthroskopischen Instrument (Bohrer oder Stößel) die oberste Knochenschicht durchbrochen, um zu erreichen, dass Blut aus der Tiefe des Knochens an die Gelenkfläche gelangt. Normalerweise ist die oberste Knochenschicht eine Grenzlinie, über die kein Blut gelangt. Mit der Unterbrechung dieser Grenzschicht gelangen aus der Tiefe des Knochens Zellen an die Oberfläche, die sich zu einem Ersatzknorpel umwandeln (Faserknorpel). Der Patient muss nach dem arthroskopischen Eingriff das betroffene Areal einige Wochen (6-8 Wochen) teilbelasten, damit diese Umwandlung stattfinden kann. Bei kleinen Arealen ist evtl. auch eine raschere Belastung möglich. Der Vorteil dieser Operation liegt darin, dass sie einfach, kostengünstig und relativ unkompliziert ist. Der Nachteil der Operation besteht darin, dass sie ungeeignet für größere Flächen ist, und dass nur ein Ersatzknorpel entsteht. Dieser Faserknorpel ist dem hyalinartigen Knorpel nach ACT unterlegen (7). Je größer der Defekt, umso schlechter ist das Ergebnis (8). Eine Verschlechterung des Ergebnisses ist nach einigen Jahren zu erwarten (9,10).
Knorpeltransplanation
Die älteste Form der Knorpeltransplantation ist die osteochondrale Transplantation. Dabei werden ein oder mehrere Knochen-Knorpelzylinder aus einem minderbelasteten Areal des Knies entnommen und in das defekte Areal eingesetzt. Der Nachteil dieses Verfahrens ist, dass zwar wenig belastete, jedoch gesunde Areale des Gelenks „geopfert“ werden. Ein weiterer Nachteil ist bei Verwendung mehrerer Zylinder, dass ein plastersteinartiges Relief entsteht, mit „Lücken“ zwischen den „Plastersteinen“ und einer unregelmäßigen Oberfläche. Der Vorteil des Verfahrens ist, dass Originalknorpel eingesetzt wird und nicht ein Faserknorpel.
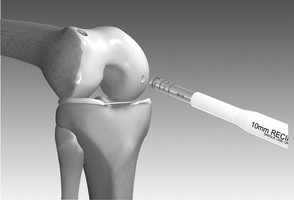
Die autologe Chondrozytentransplantation (ACT) wird seit ca. 20 Jahren durchgeführt. Es wird dabei in einem ersten arthroskopischen Eingriff gesunder Knorpel entnommen und im Labor vermehrt. In einem zweiten arthroskopischen oder offenen Eingriff wird nach einigen Wochen der gezüchtete Knorpel in den Defekt eingesetzt (Video ACT, Quelle: Codon)
Der Vorteil dieses Verfahrens ist, dass ein hyalinartiger Knorpel implantiert wird, der Nachteil, dass zwei Operationen notwendig sind und dass es sich um ein aufwändiges und kostenintensives Verfahren handelt. (Die gesetzlichen und die meisten der privaten Krankenkassen zahlen diese Operation am Knie). Seit der Erstimplantation vor 20 Jahren haben Weiterentwicklungen zu verschieden Generationen an OP-Techniken geführt. Während ursprünglich eine Knorpelsuspension unter einen Knochenhautlappen eingenäht wurde, steht jetzt eine vierte Generation der Technik zur Verfügung, bei der z.B. dreidimensionale Knorpelzellkonstrukte (Sphäroide) ohne Fremdmatrix in den Defekt eingebracht werden. Nach der Operation muss der Patient ähnlich wie bei den anderen OP-Techniken 6 bis 8 Wochen das betroffene Areal teilbelasten. Ist der Bereich zwischen Oberschenkelknochen und Schienbein betroffen, bedeutet das 6-8 Wochen Krücken, ist der Raum hinter der Kniescheibe betroffen, bedeutet das, dass die Beugung für einige Wochen unter Belastung eingeschränkt wird, dass aber Krücken evtl. nur einige Tage notwendig sind. (siehe Rehaschema)
Insgesamt braucht der neue Knorpel ca. ein Jahr zur Reifung. Risikosport sollte frühestens erst nach einem Jahr durchgeführt werden.
WIR VERWENDEN ZWEI VERSCHIEDENE TECHNIKEN DER ACT
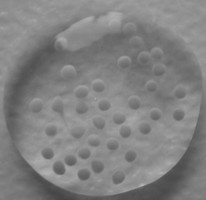
1. Die Technik der Fa. Codon. Es werden dabei beim Zweiteingriff (6 Wochen nach Entnahme) kleine Knorpelkügelchen in den Defekt eingebracht, die über Adhäsionskraft festhalten. Jedes dieser Kügelchen (Sphäroide) enthält ca. 200.000 Knorpelzellen.
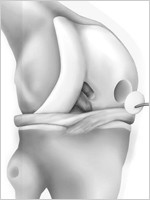
2. Die Technik der Fa. Aesculap. Es wird dabei entweder eine dreidimensionale Matrix eingebracht (z.B. falls der Knochen auch einen Defekt aufweist) oder ein Knorpelgel. Die Implantation erfolgt dabei drei Wochen nach der Knorpelentnahme.
Ursprünglich wurde die ACT als Therapieverfahren für Patienten zwischen dem 18. und 50. Lebensjahr empfohlen. Zwischenzeitlich wurde nachgewiesen, dass die Methode auch bei Kindern und Jugendlichen wirkt (11, 12). Wir halten jedoch das körpereigene Regenerationspotential beim Kind und Jugendlichen für so gut ausgeprägt, dass wir in diesen Fällen meist auf eine ACT verzichten. Beim Patienten jenseits des 50.Lebensjahres besteht u.U. auch dann eine Indikation zur ACT, wenn es sich um einen isolierten Knorpelschaden handelt und keine Zeichen einer Arthrose vorliegen. Mehrere Studien zeigen die grundsätzliche Wirksamkeit des Verfahrens auch bei älteren Patienten (13).
In einer Studie mit 1.363 Patienten wurde gezeigt, dass die Wiederaufname von Sport nach den verschiedenen Knorpeloperationen unterschiedlich ist(14). Patienten nach OCT beginnen am schnellsten wieder mit dem Sport. Patienten nach ACT benötigen hierfür deutlich länger, erreichen im Verlauf aber das durchschnittlich höchste Sportniveau. Auch ist der Anteil der Patienten, die nach OCT oder ACT in den zuvor ausgeübten Sport zurückkehren, höher als der nach Mikrofrakturierung (15).
Sportler beginnen zwar nach Mikrofrakturierung rascher mit dem Sport als nach ACT, die Langzeitergebnisse nach ACT sind jedoch besser (16).
Literatur:
- (1) Mollenhauer J, Kuettner KE. Articular Cartilage. In: Dee R, Hurst LC, Gruber MA, Stephen A, eds. Principles of Orthopaedic Practice. 2nd ed. Kottmeier. New York: McGraw Hill; 1997
- (2) Gaissmaier C, Fritz J, Schewe B et al. Cartilage Defects: Epidemiology and Natural History. Osteo Trauma Care 2006; 14: 188–194
- (3) Anderson DD, Chubinskaya S, Guilak F et al. Post-traumatic osteoarthritis: improved understanding and opportunities for early intervention. J Orthop Res 2011; 29: 802–809
- (4) Pena E, Calvo B, Martinez MA et al. Effect of the size and location of osteochondral defects in degenerative arthritis. A finite element simulation. Computers in biology and medicine 2007; 37: 376–387
- (5) Chen CT, BhargavaM, Lin PM et al. Time, stress, and location dependent chondrocyte death and collagen damage in cyclically loaded articular cartilage. J Orthop Res 2003; 21: 888–898
- (6) Niemeyer P et al: Stellenwert der autologen Chondrozytentransplantation (ACT)in der Behandlung von Knorpelschäden des Kniegelenks – Empfehlungen der AG Klinische Geweberegeneration der DGOU. Z Orthop Unfall 2013; 151: 38–4
- (7) Saris DB, Vanlauwe J, Victor J et al. Characterized chondrocyte implantation results in better structural repair when treating symptomatic cartilage defects of the knee in a randomized controlled trial versus microfracture. Am J Sports Med 2008; 36: 235–246
- (8) Mithoefer K, McAdams T,Williams RJ et al. Clinical efficacy of the microfracture technique for articular cartilage repair in the knee: An evidence- based systematic analysis.AmJ SportsMed2009; 37: 2053–2063
- (9) Mithoefer K, Williams 3rd RJ, Warren RF et al. The microfracture technique for the treatment of articular cartilage lesions in the knee. A prospective cohort study. J Bone Joint Surg Am 2005; 87: 1911–1920
- (10) Kreuz PC, Steinwachs MR, Erggelet C et al. Results after microfracture of full-thickness chondral defects in different compartments in the knee. Osteoarthritis Cartilage 2006; 14: 1119–1125
- (11) Schmal H, Pestka JM, Salzmann G et al. Autologous chondrocyte implantation in children and adolescents. Knee Surg Sports Traumatol Arthrosc 2012 May 3 [Epub ahead of print]
- (12) Gudas R, Simonaityte R, Cekanauskas E et al. A prospective, randomized clinical study of osteochondral autologous transplantation versus microfracture for the treatment of osteochondritis dissecans in the knee joint in children. J Pediatr Orthop 2009; 29: 741–748
- (13) Rosenberger RE, Gomoll AH, Bryant T et al. Repair of large chondral defects of the knee with autologous chondrocyte implantation in patients 45 years or older. Am J Sports Med 2008; 36: 2336–2344
- (14)Mithoefer K, Hambly K, Della Villa S et al. Return to sports participation after articular cartilage repair in the knee: scientific evidence. Am J Sports Med 2009; 37 (Suppl. 1): 167S–176S
- (15) Steinwachs M, Engebretsen L, Brophy RH. Scientific evidence base for cartilage injury and repair in the athlete. Cartilage 2012; 3: 11S–17S
- (16) Kon E, Filardo G, Berruto M et al. Articular cartilage treatment in highlevel male soccer players: a prospective comparative study of arthro- scopic second-generation autologous chondrocyte implantation versus microfracture. Am J Sports Med 2011; 39: 2549–2557
